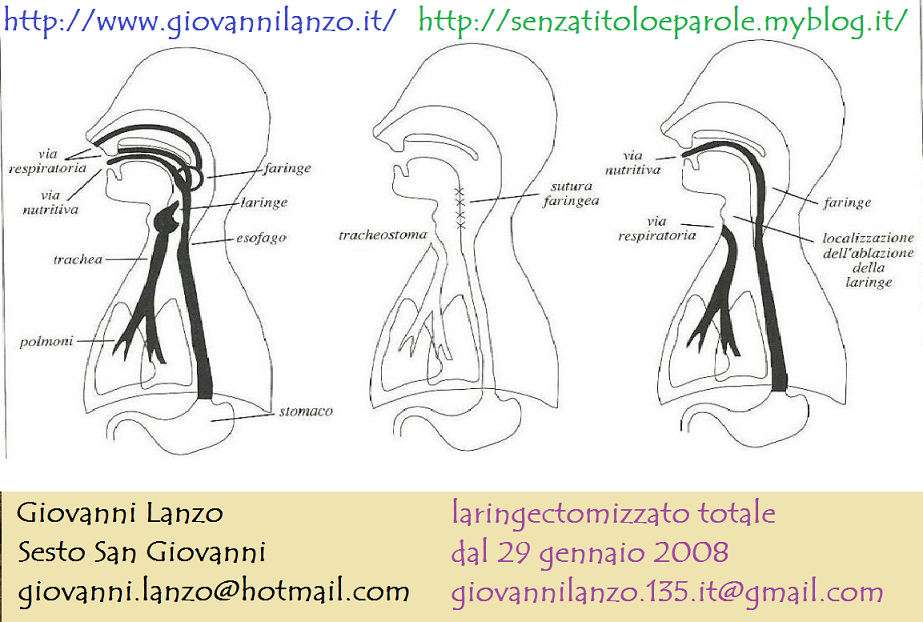
Archivio tag: tracheostoma
La Laringe
La Laringe
a cura del Dr. Alberto Rocco
Specialista in Otorinolaringoiatria e Chirurgia Cervico Facciale
Azienda Ospedaliera San Camillo-Forlanini – Roma –
numero unico di prenotazioni: 06/60 50 73 10
da lunedi a venerdi ore 9-20
![]()
La Laringe è un organo posto nella regione centrale ed anteriore del collo in continuità con la faringe, in alto, e con la trachea, in basso. Essa determina, con la sua prominenza, il cosiddetto “pomo d’Adamo”, presente in entrambi i sessi ma più evidente nell’uomo.
Schematicamente si suddivide in tre porzioni:
-
porzione sopraglottica corrispondente al tratto iniziale (superiore) in diretto rapporto con la faringe; comprende l’epiglottide, una piccola cartilagine che ha la funzione di coprire il tratto respiratorio dalla inalazione di cibo durante l’alimentazione;
-
porzione glottica corrispondente alle corde vocali è la parte da cui ha origine la voce;
-
porzione sottoglottica corrispondente alla parte che si continua con la trachea.
La laringe svolge le seguenti funzioni:
-
funzione protettiva: consiste nell’impedire l’ingresso degli alimenti nella trachea e viene svolta dall’epiglottide che funge da coperchio della laringe nel momento della deglutizione;
-
funzione fonatoria: consiste nella produzione della voce attraverso le vibrazioni delle corde vocali messe in movimento dall’aria in uscita dai polmoni;
-
funzione respiratoria assicura il passaggio dell’aria proveniente dal naso e diretta ai polmoni.
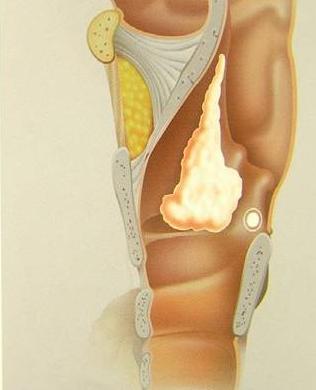
I tumori maligni della laringe sono i tumori più frequenti del distretto otorinolaringoiatrico.
La guarigione dei pazienti che si ammalano di un tumore della laringe varia in funzione dell’estensione e della sede iniziale della neoplasia e nei casi più favorevoli può arrivare al 95%.
L’età maggiormente colpita è compresa tra 50 e 70 anni.
I fattori di rischio principali per l’insorgenza dei tumori della laringe sono il fumo di tabacco e l’alcool.
I sintomi di esordio di un tumore laringeo variano in funzione della sede di insorgenza.
Per i tumori della regione sopraglottica, che prende parte soprattutto al meccanismo della deglutizione, il sintomo più frequente è la disfagia (fastidio ad inghiottire). Può comparire anche dolore che spesso si irradia verso l’orecchio; talvolta il sintomo di esordio può essere l’aumento di volume di uno o più linfonodi del collo per la ricca presenza di vasi linfatici di questa regione;

per i tumori della regione glottica, che prende parte al meccanismo dell’emissione della voce, il sintomo più frequente è la disfonia (voce rauca) ingravescente, cioè con tendenza a peggiorare nel tempo e resistente alla terapia medica;
per i tumori della regione sottoglottica, che sono molto rari, i sintomi tendono a comparire quando la crescita della neoplasia riduce considerevolmente lo spazio respiratorio, determinando dispnea o quando vengono interessate le corde vocali.
La diagnosi precoce cioè negli stadi iniziali della crescita neoplastica, permette maggiori possibilità di guarigione e anche scelte terapeutiche che rendono possibile, a volte, la conservazione della laringe e quindi delle sue funzioni.
Per formulare una corretta diagnosi risultano di fondamentale importanza alcune indagini strumentali, tra le quali:
-
 laringoscopia indiretta: consiste nella visualizzazione della laringe tramite uno specchietto; è l’esame che si esegue per primo in caso di necessità ed è pratico, rapido ed indolore. Se effettuato da mani esperte permette nella maggior parte dei casi di formulare una corretta diagnosi dell’eventuale patologia laringea e di escludere o confermare la presenza di un tumore della laringe;
laringoscopia indiretta: consiste nella visualizzazione della laringe tramite uno specchietto; è l’esame che si esegue per primo in caso di necessità ed è pratico, rapido ed indolore. Se effettuato da mani esperte permette nella maggior parte dei casi di formulare una corretta diagnosi dell’eventuale patologia laringea e di escludere o confermare la presenza di un tumore della laringe;
-
 laringoscopia con fibre ottiche: consiste nella visualizzazione della laringe attraverso una piccola telecamera situata all’interno di un fibroscopio, uno strumento sottile e flessibile che viene introdotto attraverso il naso per arrivare in stretta prossimità della laringe stessa;
laringoscopia con fibre ottiche: consiste nella visualizzazione della laringe attraverso una piccola telecamera situata all’interno di un fibroscopio, uno strumento sottile e flessibile che viene introdotto attraverso il naso per arrivare in stretta prossimità della laringe stessa;
-
 laringoscopia in sospensione: è l’esame più valido per la diagnosi definitiva; permette di effettuare la biopsia della lesione sospetta (prelievo di tessuto per l’analisi microscopica) e a volte consente di eseguire interventi chirurgici risolutivi in presenza di lesioni iniziali che interessano una piccola porzione delle corde vocali o di altri distretti laringei. Ha il limite di richiedere l’anestesia generale e pertanto il ricovero del paziente.
laringoscopia in sospensione: è l’esame più valido per la diagnosi definitiva; permette di effettuare la biopsia della lesione sospetta (prelievo di tessuto per l’analisi microscopica) e a volte consente di eseguire interventi chirurgici risolutivi in presenza di lesioni iniziali che interessano una piccola porzione delle corde vocali o di altri distretti laringei. Ha il limite di richiedere l’anestesia generale e pertanto il ricovero del paziente.
Il precorso diagnostico delle neoplasie laringee prevede anche l’esecuzione di indagini quali la risonanza magnetica (RM) o la tomografia computerizzata (TAC) per valutare l’eventuale estensione della malattia nei tessuti profondi che non sono visibili alla laringoscopia in sospensione.
Il trattamento varia in funzione delle dimensioni e della localizzazione del tumore e prevede l’impiego della Chirurgia, della Radioterapia o della Chemioterapia, sia singolarmente sia in combinazione tra loro.
Chirurgia
Schematicamente l’intervento chirurgico può essere di:
-
 cordectomia: si suddivide in 5 tipi dalla più superficiale che interessa solo la mucosa di rivestimento della corda vocale (decorticazione) alla più profonda che consiste nella rimozione completa della corda vocale;
cordectomia: si suddivide in 5 tipi dalla più superficiale che interessa solo la mucosa di rivestimento della corda vocale (decorticazione) alla più profonda che consiste nella rimozione completa della corda vocale;
-
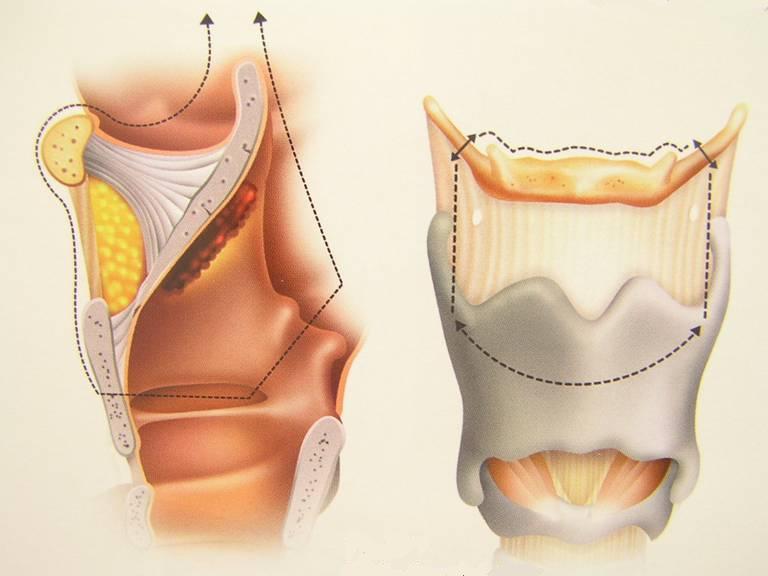 laringectomia parziale: si esegue nelle fasi avanzate del tumore ma vengono conservate alcune porzioni della laringe e conseguentemente vengono risparmiate le sue funzioni fondamentali. La tracheotomia viene richiusa definitivamente dopo un adeguato periodo di rieducazione finalizzato al recupero della respirazione per le vie naturali, della fonazione e della deglutizione;
laringectomia parziale: si esegue nelle fasi avanzate del tumore ma vengono conservate alcune porzioni della laringe e conseguentemente vengono risparmiate le sue funzioni fondamentali. La tracheotomia viene richiusa definitivamente dopo un adeguato periodo di rieducazione finalizzato al recupero della respirazione per le vie naturali, della fonazione e della deglutizione;
-
 laringectomia totale: si esegue nelle fasi più avanzate del tumore nel caso non fosse possibile conservare l’unità funzionale minima della laringe, non necessariamente per l’estensione del tumore ma anche nei casi in cui vi fosse interessamento di alcuni punti critici della laringe, anche in presenza di una neoplasia non troppo estesa. In questi casi il tracheostoma è definitivo come pure la perdita della voce naturale ma paradossalmente il periodo post-operatorio è molto meno impegnativo per il paziente visto che non è necessario il periodo di rieducazione per la ripresa delle funzioni della laringe.
laringectomia totale: si esegue nelle fasi più avanzate del tumore nel caso non fosse possibile conservare l’unità funzionale minima della laringe, non necessariamente per l’estensione del tumore ma anche nei casi in cui vi fosse interessamento di alcuni punti critici della laringe, anche in presenza di una neoplasia non troppo estesa. In questi casi il tracheostoma è definitivo come pure la perdita della voce naturale ma paradossalmente il periodo post-operatorio è molto meno impegnativo per il paziente visto che non è necessario il periodo di rieducazione per la ripresa delle funzioni della laringe.
Radioterapia
La Radioterapia ha lo scopo di distruggere le cellule tumorali utilizzando radiazioni generate da apparecchiature appositamente progettate. Con le tecniche moderne è possibile concentrare le radiazioni solo nella zona tumorale risparmiando al massimo i tessuti sani. In funzione della estensione della neoplasia il volume irradiato sarà limitato alla laringe o potrà comprendere anche i linfonodi del collo.
Il trattamento standard prevede l’erogazione di 66-70 Gy (Gy=Gray, unità di misura della dose assorbita) frazionati in sedute giornaliere che si effettuano cinque giorni alla settimana in genere sette settimane di seguito, per un totale di 35 sedute.
Quando la Radioterapia segue alla Chirurgia, la dose necessaria sarà più bassa rispetto al trattamento di Radioterapia esclusiva e la durata del trattamento conseguentemente più breve.
Gli effetti collaterali si concentrano sulle mucose comprese nel volume bersaglio e sulla cute sovrastante la zona trattata e consistono in mucosite o dermatite (infiammazione) della zona colpita in misura variabile da persona a persona ma in genere ben tollerati e di durata limitata nel tempo.
Chemioterapia
La Chemioterapia è un trattamento effettuato con farmaci che hanno lo scopo di interferire con i processi di crescita delle cellule tumorali limitandola o determinando la morte della cellula stessa.
Può essere effettuata in associazione alla Radioterapia dopo la Chirurgia (radio chemio concomitante) oppure sempre in associazione alla Radioterapia senza essere preceduta dalla Chirurgia (radio chemio esclusiva). Raramente viene eseguita come prima terapia, allo scopo di ridurre o di sensibilizzare la massa tumorale per i trattamenti successivi (chemio neo-adiuvante o induttiva).
I farmaci più utilizzati sono ancora oggi i derivati del platino (cisplatino e carboplatino) e il 5-fluorouracile. Gli effetti collaterali più comuni sono rappresentati dalla nausea e dall’infiammazione delle mucose, che in genere è possibile attenuare con alcuni trattamenti sintomatici.
E’ in fase avanzata di studio l’utilizzo di alcuni farmaci che interferiscono con la formazione dei vasi sanguigni all’interno della massa tumorale (cetuximab) e in casi selezionati vengono già introdotti nei protocolli di trattamento.
Nei casi in cui si sia deciso per la Chirurgia, il risveglio dopo l’intervento rappresenta ovviamente la fase più difficile da superare ma in realtà per motivi più psicologici che reali. Le prime ore sono quelle in cui la sensazione di non potersi muovere è maggiore per l’impedimento determinato dalla medicazione e dalla presenza dei vari sondini, drenaggi, ecc.
Nella Laringectomia totale la respirazione avviene attraverso la cannula tracheale ma questo non rappresenta assolutamente un problema per il paziente perché è l’aria ambiente che si introduce automaticamente nella cannula durante la respirazione, esattamente come avviene nel passaggio dell’aria attraverso le narici senza che la persona ne abbia consapevolezza. Quindi la respirazione avviene in maniera diversa ma senza nessuna fatica o controllo da parte del paziente.
La cannula verrà rimossa in genere tra il primo ed il terzo mese dopo l’intervento ma il tracheostoma sarà permanente e rappresenterà la nuova e definitiva via di respirazione per il paziente.
L’alimentazione, nei primi giorni dopo l’intervento, avviene tramite un sottile tubicino trasparente introdotto dentro il naso, il sondino naso-gastrico.
L’alimentazione per le vie naturali riprenderà senza nessun cambiamento dopo circa 10-12 giorni dall’intervento chirurgico.
La fonazione, dopo un periodo variabile di rieducazione con il logopedista, potrà riprendere in maniera diversa imparando ad utilizzare la cosiddetta voce esofagea che in casi frequenti permette al malato di farsi capire perfettamente in tutte le situazioni, anche al telefono, senza l’utilizzo di nessuna apparecchiatura. In effetti la voce così emessa non presenta sonorità e questa nuova capacità di parlare è variabile da persona a persona ed è questo in definitiva il vero cambiamento con il quale è necessario convivere comprendendo e superando senza traumi i limiti da questo imposti.
Nella Laringectomia parziale il decorso clinico delle prime 2-3 settimane è del tutto sovrapponibile a quello della laringectomia totale ma successivamente, con l’aiuto del logopedista, la ripresa graduale della deglutizionepermetterà la rimozione della cannula tracheale, la chiusura del tracheostoma e una ripresa della respirazione e della fonazione per le vie naturali.
Il periodo di rieducazione per la ripresa completa della deglutizione in tutte le situazioni può essere anche molto lungo (1-2-3 mesi…e oltre in casi limite) e varia in funzione del tipo di intervento ed in funzione della collaborazione/capacità del paziente a percepire il cambiamento strutturale della propria laringe.
IL TRACHEOSTOMA E LA GESTIONE DELLA CANNULA

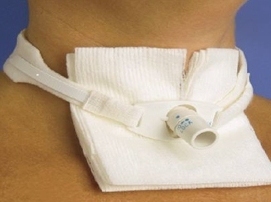 Il tracheostoma rappresenta la nuova via di passaggio dell’aria durante la respirazione. Non è necessario alcun controllo da parte del paziente che dovrà semplicemente respirare come prima dell’intervento chirurgico.
Il tracheostoma rappresenta la nuova via di passaggio dell’aria durante la respirazione. Non è necessario alcun controllo da parte del paziente che dovrà semplicemente respirare come prima dell’intervento chirurgico.
In caso di Laringectomia Totale esso rappresenta la via definitiva di respirazione mentre nel caso di Laringectomia Parziale il trachestoma è temporaneo e verrà richiuso quando si sarà riguadagnata la piena autonomia alimentare.
Il tracheostoma deve essere sempre mantenuto protetto utilizzando dei bavaglini di garza o cotone. Nel periodo invernale a questo scopo è possibile indossare maglie a collo alto mentre nel periodo estivo si possono utilizzare semplici foulard. In tutti i casi è preferibile posizionare un piccolo cerotto-filtro davanti al tracheostoma per prevenire l’infiltrazione di polvere e microparticelle nella trachea e nei polmoni.
E’ sempre bene evitare:
– gli ambienti polverosi e fumosi;
– l’esposizione a corrente d’aria diretta;
– le temperatura estreme troppo caldo o troppo freddo.
E’ inoltre necessario:
– tenere pulito il tracheostoma detergendolo con una spugnetta umida;
– durante la doccia o il bagno riparare il tracheostoma con apposite garze e non immergersi oltre l’altezza del torace per evitare l’inalazione di acqua;
– cercare di umidificare adeguatamente l’aria di casa soprattutto nel periodo invernale quando il riscaldamento è acceso.
La cannula tracheale ha lo scopo di mantenere aperto il tracheostoma durante la fase di cicatrizzazione dei tessuti per impedirne la chiusura. In entrambi i casi, di Laringectomia Totale o Parziale, verrà rimosso dopo un periodo variabile, da 1 a 3 mesi ma a volte anche molto di più, in accordo con le direttive dello Specialista Otorinolaringoiatra. Nel primo caso perché i tessuti ormai stabilizzati non avranno più la tendenza a richiudersi, nel secondo caso perché una volta terminato il periodo di rieducazione, il tracheostoma non avrà più ragione di esistere.

 La cannula è costituita da tre parti fondamentali:
La cannula è costituita da tre parti fondamentali:
– la cannula vera e propria, costituita da un tubo di plastica rigida e ricurva che viene introdotto direttamente nel tracheostoma;
– la controcannula, che consiste in un tubo di forma identica alla cannula ma leggermente più stretto che viene inserito all’interno della cannula. La sua estrazione, pulizia e reinserimento sono manovre facili che il paziente può tranquillamente autogestire;
– il mandrino che viene utilizzato esclusivamente per facilitare l’introduzione della cannula nel tracheostoma. Quest’ultima manovra nel primo periodo viene eseguita direttamente dal medico, successivamente sarà possibile l’autogestione completa da parte del paziente in funzione del suo grado di collaborazione.
La cannula può essere cuffiata o non cuffiata per la presenza o meno di un palloncino che ha lo scopo di proteggere le vie aeree dall’inalazione di cibo durante la rieducazione alimentare nelle laringectomie parziali.
La cannula deve essere tenuta con cura e soprattutto pulita. In alcuni casi a seguito di particolari movimenti o colpi di tosse, si potrebbe notare qualche piccola striatura di sangue nel muco espulso, questo è un fenomeno che non deve preoccupare perché è dovuto alla rottura di piccoli capillari.
Per pulire la controcannula, sbloccare innanzitutto l’anello che la tiene bloccata alla cannula e quindi estrarla con delicatezza; porla sotto un getto d’acqua e rimuovere ogni residuo interno aiutandosi con l’apposito spazzolino; asciugarla con cura al suo interno con l’aiuto di garze e reintrodurla nella cannula.
Per pulire la cannula valgono le stesse indicazioni con l’unica differenza di tecnica di estrazione e reintroduzione in trachea mediante l’utilizzo del mandrino, che vi verrà spiegata dal medico specialista.
In caso di Laringectomia Totale trascorso un primo periodo in cui è necessario portare la cannula si può iniziare la fase di riabilitazione vocale. Questa è effettuata sotto la guida dei logopedisti che insegnano ai laringectomizzati come riprendere a comunicare utilizzando diverse tecniche in funzione delle caratteristiche fisiologiche individuali. I risultati sono ottimi e la gran parte dei pazienti riacquista in poche sedute la capacità di comunicare con una voce priva di sonorità ma perfettamente udibile dagli interlocutori, persino al telefono.
Negli altri casi in cui non sia possibile imparare la voce esofagea esistono alternative alla comunicazione mediante protesi fonatorie interne ed esterne (laringofono), che il chirurgo consiglierà di volta in volta al paziente in funzione delle diverse situazioni cliniche e socio-familiari.
Il tumore della laringe soprattutto se diagnosticato nelle fasi iniziali, ha una buona percentuale di guarigione anche per la scarsa tendenza a dare metastasi a distanza.
E’ necessario che il paziente e i familiari comprendano e accettino tutte le diverse fasi del percorso diagnostico-terapeutico proposto dal chirurgo per facilitare la realizzazione della miglior soluzione terapeutica possibile per il paziente.
Allo stesso modo, nel periodo post-operatorio, è estremamente importante che il paziente si sottoponga ai regolari controlli (follow-up) che il chirurgo prescriverà al paziente, corredati da tutti gli esami clinico-strumentali, previsti nei vari periodi.
Il periodo dei controlli dura di norma 5 anni che rappresentano il periodo di rischio per il paziente, trascorso il quale la possibilità di riammalarsi di un secondo tumore diminuisce in maniera significativa.
E’ importante comunque che il paziente sia il primo medico di se stesso sorvegliando attivamente il proprio stato di salute ed è naturalmente necessario smettere di fumare.
http://www.orecchio-naso-gola.it/laringe.htm
La funzione respiratoria dopo la laringectomia
Recuperare voce, gusto e olfatto dopo l’intervento si può
Cancro della laringe, interventi d’avanguardia a Taormina
L’Unità di otorinolaringoiatria e chirurgia cervico facciale diretta dal dott. Politi ancora protagonista di complesse operazioni che hanno salvato la vita ai pazienti riuscendo a restituire loro anche la voce

il dott. Antonio Politi
L’Unità di Otorinolaringoiatria e chirurgia cervico facciale ad indirizzo oncologico dell’Ospedale San Vincenzo di Taormina, diretta dal dott. Antonio Politi, si conferma sempre più all’avanguardia nella lotta ai tumori.
In particolare viene trattato in questo reparto con tecniche ormai di riferimento assoluto per l’intero Sud Italia il cancro della laringe, la neoplasia più frequente tra i tumori della testa e del collo: le cause sono il fumo, l’alcool, e recentemente si sono aggiunte cause virali legate al “papilloma virus”.
Una volta colpiva quasi solo gli uomini, adesso il gap con le donne va sempre più assottigliandosi. Quando ad un paziente viene diagnosticato il cancro della laringe, non solo si ingenera la paura di soffrire o di morire, ma anche l’eventualità della perdita della voce o di rimanere tutta la vita con il tracheostoma. Nei giorni scorsi, al “San Vincenzo”, è stato eseguita per la prima volta in Sicilia una ricostruzione delle corde vocali tramite muscoli anteriori del collo (sternoioidei), raffinato intervento “inventato” dal prof. Aldo Garozzo, regalando così al paziente una efficace neo-voce.
E sempre di recente è stato eseguito un altro intervento ricostruttivo e sofisticato, essendo asportata parte della laringe dove aveva sede il tumore che infiltrava sia le corde vocali che la regione sottostante – e ricostruendo l’organo fonatorio con la stessa trachea del malato (tracheoioidoepiglottidopessia). Le operazioni di chirurgia ricostruttiva vengono riservate a casi selezionati, e seguiti dalla riabilitazione logopedica, senza la quale tutto verrebbe vanificato.
“Oggi – spiega il dott. Politi – si è nelle condizioni di poter fare una selezione più accurata degli interventi per i pazienti oncologici testa/collo garantendo a tutti la voce: dalla laserchirurgia per tumori cordali allo stadio iniziale, alle laringectomie parziali ricostruttive, ma anche nel caso meno frequente di laringectomie totali, avvalendosi della riabilitazione logopedica o delle protesi fonatorie, piccolo gioiello bioingegneristico.
Il paziente oncologico cervico facciale, per le sue peculiari problematiche deglutitorie, fonatorie, respiratorie, va operato e seguito nel proprio territorio, nella volontà di percorrere un lungo percorso prima di guarigione e poi di controllo insieme al medico ed agli assistenti che lo hanno preso in cura e che a lui si sono dedicati con le tecniche chirurgiche ed assistenziali più moderne”. Al “San Vincenzo”, attorno al paziente oncologico cervico facciale si muove una comunità multidisciplinare composta non solo dai chirurghi Orl, ma anche oncologi, onco radiologi, anestesisti e terapisti del dolore, anatomopatologi, gastroenterologi, radiologi, psicologi, infermieri dedicati, logopedisti.
La voce è la peculiarità del genere umano ed ecco perché vi è la necessità assoluta di “estirpare” una malattia così devastante, e la sfida resta nel non privare il paziente della massima espressione della comunicazione, ciò che rappresenta l’uomo e lo fa riconoscere in società. Oggi si eseguono interventi di laringectomia ricostruttiva, e non più totale come un tempo ed è grande la differenza: anche asportando le corde vocali, si garantisce sia una buona voce che l’affrancamento dalla tracheotomia a permanenza, una tremenda stimmate postoperatoria.
week end a Desio
Desio 15 marzo 2012
Mi trovo disteso su un letto d’ospedale pronto per un altro intervento,dopo 4 anni anche se questa volta si tratta di una semplice plastica di allargamento del tracheostoma e un prelievo di materiale da mandare a fare la biopsia,ma questo mi comporterà l’uso della cannula laringea per un periodo che ancora non so.
Sono tranquillo perché so che sono in buone mani qui al reparto otorino di Desio e il prof Milanesi è un ottimo primario che ha uno staff e un reparto che per me il plus ultra.
L’ultimo ricordo prima che l’anestesia faccia effetto e il viso del dottor Milanesi e dell’anestesista che da ordini di radermi i peli del collo per risvegliarmi mentre mi riportano in reparto.
Dopo un ora dalla fine dell’operazione sono già sveglio,come cambia la medicina ancora mi ricordo che a 10 anni un anestesia per un appendicite mi aveva reso uno zombie per 3 giorni ed oggi invece dopo un ora ero già sveglio come mi capito anche quando subi la laringectomia totale.
Purtroppo il mio stoma sembra instabile e quindi portato allo stringimento ma ancora non mi sbilancio aspettando l’esito della biopsia e venerdì quando tornerò a Desio per togliere i punti.
Certamente noi che abbiamo uno stoma sul collo dobbiamo fare controlli perché da quel “foro” ci entra la linfa per poter continuare a respirare e vivere e quindi meglio attenersi alle disposizioni degli otorini e non agire mai di testa propria magari eliminando la cannula prima del tempo,anche se nel mio caso non dipende da questo il restringimento.
Oggi domenica non sono ancora al top per via dei punti che tirano un po’ e nei giorni prossimo farò una relazione più dettagliata dei due giorni di Desio
Giovanni Lanzo
Tracheostomie e tracheostomizzati
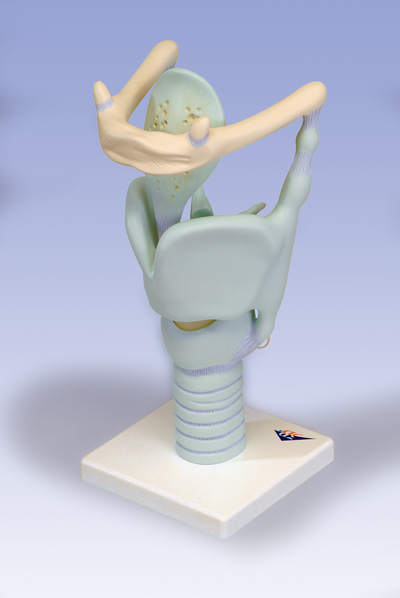
CENNI DI ANATOMIA
Laringe
Organo della fonazione, situato all’estremità superiore della trachea e davanti alla faringe. E’ una complessa cavità vestibolare che si apre nella trachea provenendo dalla faringe.
La laringe consta di nove pezzi cartilaginei. Le principali strutture cartilaginee sono le seguenti:
· cartilagine tiroidea volgarmente detta “pomo di adamo”
· l’epiglottide
· la cricoide, che è la più bassa delle nove cartilagini
· Le aritenoidi
L’epiglottide durante la deglutizione copre come un coperchio l’apertura superiore della laringe favorendo in questo modo il passaggio di cibi e liquidi nell’ipofaringe-esofago; le aritenoidi portano a chiusura il piano glottico (formato dalle corde vocale vere), impedendo ad ogni atto di deglutizione il passaggio in trachea degli alimenti che causerebbero altrimenti tosse, spasmo e soffocamento.
La membrana mucosa che riveste internamente la laringe, forma, circa a metà altezza, due sporgenze orizzontali antero-posteriori conosciute col nome di corde vocali false.
Le corde vocali vere invece, sono due sporgenze maggiori per dimensione delle corde vocali false, ma disposte al di sotto di esse e collegate al movimento delle aritenoidi.
La disposizione e la diversa tensione delle corde vocali vere genera i diversi suoni della voce.
Trachea
E costituita da anelli cartilaginei incompleti, a forma di C aperti posteriormente.
E’ lunga circa 15 cm e si estende dalla laringe ai bronchi.
Funge da passaggio dell’aria dall’esterno verso i polmoni, la sua ostruzione anche per poco tempo, causa asfissia e morte.

Tracheostomia
Per tracheostomia si intende il posizionamento di una via aerea definitiva (cannula trachestomica) tramite uno stoma creato per via percutanea o chirurgicamente, è un abboccamento della cute ai margini di apertura della trachea e viene eseguita per situazioni di lunga permanenza. Si tratta di un procedimento elettivo eseguito in anestesia locale o generale.
Si differenzia dalla tracheotomia che consiste in una apertura chirurgica della trachea che ha lo scopo di creare una nuova via aerea bypassando la glottide, per poter introdurre dall’esterno una cannula ( E’ una semplice breccia tra cute e trachea) e può essere eseguita d’urgenza o programmata, temporanea, permanente o profilattica.
Le indicazioni principali a questi tipi di intervento sono:
· tutti i casi di emergenza che comportano una grave insufficienza respiratoria (importanti lesioni cranio-cerebrali, del massiccio facciale e della laringe)., corpi estranei, paralisi delle corde vocali
· interventi di chirurgia parziale e ricostruttiva della laringe, grosse demolizioni del cavo orale e dell’oro-ipofaringe.
· alcuni casi di flogosi acuta della laringe con edema importante che non risponde alla terapia medica.
La tracheostomia si propone i seguenti scopi:
Realizzare una comunicazione diretta tra aria ambiente e vie aeree inferiori ,superando eventuali ostacoli.
Ridurre lo spazio morto anatomico e migliorare la ventilazione alveolare.
Consentire una accurata pervietà delle vie aeree permettendo una valida pulizia tracheo-bronchiale
Stabilire una netta e completa separazione tra vie aeree e digestive
Rendere possibile un corretto e sicuro collegamento del paziente ad un ventilatore automatico
Diminuire le resistenze al flusso di gas del ventilatore stesso
Permettere nei pazienti coscienti la ripresa di una normale alimentazione per via orale.
La tracheostomia e’ quindi preferibile in quei pazienti che richiedono una ventilazione meccanica prolungata.
LA CANNULA TRACHEALE
Materiali utilizzati per la costruzione di cannule tracheali
I materiali impiegati nella costruzione delle CT devono rispondere a precise caratteristiche di atossicità e superare i test d’efficacia .
I materiali più utilizzati oggi sono il PVC , il silicone e metallo ( ottone, ottone argentato, argento, oro e acciaio).
Le prime CT utilizzate furono quelle in gomma naturale (ormai non più in uso) e le CT metalliche (di Jackson). Queste ultime vengono tutt’oggi utilizzate in chirurgia ORL e in pazienti portatori di tracheotomie di lunga durata o permanenti.
Questo tipo di materiale dà la possibilità di poter variare artigianalmente il diametro, la curvatura e la lunghezza della CT (ovvero di personalizzare la cannula);
gli svantaggi sono la rigidità e la possibilità di ossidazione ed erosione della cromatura esterna in caso di secrezioni tracheali particolarmente acide.
Il silicone è un elastomero, che, per alcune sue caratteristiche, è apparentemente uno dei più idonei, infatti, oltre ad avere elevata tollerabilità può essere sterilizzato in autoclave.
Tra gli svantaggi nell’utilizzo di questo materiale abbiamo: l’alto costo, l’elevato attrito di superficie, l’elevata memoria (tendenza a riassumere la forma originale).
PVC medicato privo di lattice, anallergico. Tale materiale atossico termosensibile e radiopaco risulta confortevole per il paziente e riduce il rischio di lesioni tracheali.
Questo tipo di materiale è ad oggi il più utilizzato.
CARATTERISTICHE GENERALI
La cannula tracheale è composta da tre elementi:
- Cannula
- Controcannula e
- Mandrino
La cannula
mantiene la tracheostomia pervia consentendo una normale respirazione. La parte curva del tubo è posizionata nella trachea, mentre la flangia nella parte esterna.
La cannula viene fissata saldamente per mezzo di fettucce di fissaggio che vengono fatte passare attraverso i fori della flangia.
Mandrino
È posto all’interno della cannula nella fase di posizionamento della stessa. Esso serve per facilitare l’introduzione della cannula rendendo la manovra atraumatica.
Controcannula
Viene inserita dentro la cannula dopo il posizionamento e serve a mantenere pulita la cannula interna evitando che questa debba essere rimossa durante le manovre di pulizia.
La ISO (International Organization for Standardization) ha stabilito dei parametri entro cui devono rientrare le caratteristiche delle CT. Per comodità didattica distinguiamo le caratteristiche in intrinseche ed estrinseche.
Le caratteristiche intrinseche sono quelle presenti in tutte le cannule anche se con parametri diversi; esse sono: il diametro, la lunghezza, la forma, la flangia, il tratto esterno e la punta.
Le caratteristiche estrinseche sono quelle che differenziano le CT tra di loro. Le CT, infatti, possono essere cuffiate, non cuffiate, fenestrate o cuffiate fenestrate.
CARATTERISTICHE INTRINSECHE
Diametro
In passato le CT venivano identificate in base alle dimensioni del diametro esterno (OD); questa classificazione, detta di Jackson, è ancora utilizzata per le cannule metalliche.
Attualmente la classificazione utilizzata per individuare le CT è quella che tiene conto del diametro interno (ID). Non tutte le CT hanno l’ID uguale in tutta la sua lunghezza, pertanto si fa riferimento all’ID più prossimo alla flangia.
Il diametro della cannula varia in base alle dimensioni dello stoma tracheale.
Le cannule generalmente hanno un calibro compreso tra 9.4 e 13.8 mm. Nell’adulto.
Lunghezza
La lunghezza è un parametro molto variabile è dipende dalla ditta produttrice, generalmente tra 65 e 81 mm.
Forma
In base alla forma le CT possono essere suddivise in angolate e a semicerchio. Le CT angolate sono quelle che vengono solitamente utilizzate nelle tracheotomie percutanee. Sono costituite da due braccia, uno orizzontale, che è quello che si continua con la flangia, uno verticale endotracheale, e da una curvatura che deve essere obbligatoriamente ad angolo ottuso.
Questa forma è sicuramente quella più anatomica, rispettando il più possibile le varie strutture.
Nelle CT a semicerchio invece le due braccia si continuano l’una nell’altra senza formare un vero angolo. Questa forma è tipica delle CT rigide e semirigide (metalliche, PVC). Esse di solito sono dotate di controcannula e sono destinate a tracheotomie di lunga durata o permanenti.
Flangia
La flangia è una lamina posta perpendicolarmente alla cannula. Essa è il limite oltre il quale la CT non può essere inserita nella tracheotomia; infatti, oltre a determinare la lunghezza della stessa cannula ne permette la fissazione attraverso piccoli fori a forma di asola posti ai suoi lati, attraverso i quali si fanno passare i lacci che vengono legati dietro la nuca.
La flangia di solito è saldata alla cannula, ma esistono CT in cui essa può scorrere lungo tutto il suo tratto orizzontale, permettendone l’adattamento a seconda delle singole esigenze.
Tratto esterno
E’ la porzione posta verso il lato esterno della flangia, le sue dimensioni variano a seconda della ditta produttrice, solitamente ha forma cilindrica e una lunghezza di circa 1,5 cm. Nelle CT angolate senza controcannula esso può essere fuso alla flangia o essere rimovibile. Nelle cannule a semicerchio di solito è saldato alla controcannula. La sua funzione, oltre che permettere di collegare il terminale del respiratore, è anche quella di poter estrarre agevolmente la controcannula.
Punta
E’ l’estremità endotracheale della cannula è solitamente smussa; di solito ha una sezione cilindrica perpendicolare all’asse lungo del braccio endotracheale, in modo da formare con questo un angolo di 90°; in alcune cannule può avere anche la forma a becco di flauto, purché l’angolo ß sia maggiore di 50°
CARATTERISTICHE ESTRINSECHE
CANNULE CUFFIATE
Sono provviste di un manicotto esterno (o cuffia) gonfiabile a bassa pressione per mezzo di un manometro o di una siringa e consentono di mantenere una buona tenuta sulla parete tracheale. La pressione della cuffia non deve superare i 20/25 mmHg.
Questo tipo di cannula consente il mantenimento di volumi di ventilazione costanti durante la VMI (ventilazione meccanica intensiva o integrata) per assenza di fughe d’aria e previene episodi di inalazione in pazienti disfagici o con alterazione dello stato di coscienza.
La cuffia, pur con modesta pressione alla parete della trachea, può causare lesioni da decubito e da compressione ischemizzante sulla mucosa tracheale. Tale evenienza può essere evitata sgonfiando periodicamente la cuffia nell’arco della giornata o con l’utilizzo di speciali cuffiature a bassa pressione o a doppia cuffiatura.
Presenta anche altri svantaggi quali, il maggior traumatismo durante le manovre di sostituzione. Può necessitare inoltre di frequenti sostituzioni per rotture alla cuffia, usura del sistema di gonfiaggio.
Nursing
Informare sempre il paziente circa le manovre che verranno effettuate. Controllo e mantenimento di adeguati valori pressori a livello della cuffia in quanto l’introduzione di eccessivi volumi d’aria può creare problemi ischemici da compressione e favorire l’insorgenza di lesioni e stenosi tracheali.
Umidificazione dell’aria inspirata e aerosol terapia onde prevenire la possibile formazione di tappi di muco.
Mantenimento di una corretta igiene dello stoma, sostituzione periodica del materiale accessorio (filtro, garza, fascetta, ecc).
CANNULE NON CUFFIATE
Il loro utilizzo è consigliato in assenza di problemi di deglutizione, durante training di rimozione della cannula e qualora sia necessario mantenere la broncoaspirazione.
Inoltre il loro utilizzo può essere riservato ai pazienti avviati ad un programma di adattamento alla ventilazione non invasiva. L’utilizzo di queste cannule permette:
1 la fonazione a cannula chiusa
2 la riduzione del rischio di insorgenza decubiti tracheali
3 una maggior facilità di gestione
4 minor traumatismo durante le manovre di sostituzione
5 facilita l’inizio del training di svezzamento con progressiva riduzione del calibro della cannula fino alla chiusura della stomia.
Gli svantaggi sono che è difficilmente utilizzabile durante la ventilazione meccanica e che non vengono prevenuti episodi di inalazione e sanguinamento della trachea.
Nursing
E’ importante:
- valutare il paziente a cannula chiusa (parlare con tracheostomia) ;
- controllare l’evoluzione del processo di chiusura dello stoma in corso di progressiva riduzione del calibro;
- utilizzare idrocolloidi adesivi o poliuretano al fine di ottenere una perfetta tenuta dello stoma intorno alla cannula ed evitare così fughe di aria che potrebbero condizionare sfavorevolmente l’efficacia della ventilazione non invasiva; della tosse o della fonazione.
CANNULE FENESTRATE
Presentano un foro ovoidale a livello della porzione posteriore e superiore. Scopo della fenestratura è di consentire il passaggio di aria attraverso le corde vocali e con esso la fonazione. Le cannule fenestrate sono dotate di controcannula che ne consente l’utilizzo in ventilazione e riduce il rischio di lesioni della mucosa durante le manovre di broncoaspirazione.
Gli svantaggi sono legati alla maggior complessità di gestione dovuta a dotazione di più accessori, alla necessaria manipolazione della controcannula che potrebbe determinare un maggiore rischio di contaminazione batterica ed infine potrebbero insorgere con più facilità i granulomi in sede della fenestratura.
Nursing
· Le manovre di broncoaspirazione devono essere effettuate solo dopo aver posizionato la controcannula non fenestrata.
· Segnalazione precoce di ostacoli o sanguinamenti durante la manovra d’introduzione della controcannula.
· Educazione del paziente ad una gestione ottimale di tutti gli accessori in dotazione e alle procedure igieniche da seguire al fine di ridurre i rischi di contaminazione ( uso di detergenti, scovolini, disinfettanti specifici)
INTERVENTI INFERMIERISTICI DI PREPARAZIONE ALL’INTERVENTO DI TRACHEOSTOMIA
1.Misure Generali:
Informare il paziente (se cosciente);
Valutare e verificare il monitoraggio di FC, PA, ETCO2, SPO2;
Verificare la presenza di accesso venoso;
Valutare la presenza di set di aspirazione adeguato;
Verificare la pronta disponibilita’ di elettrobisturi, defibrillatore, fibroscopio flessibile e carrello d’urgenza all’interno della stanza;
Preparazione del materiale di uso sterile:
camici sterili, campo chirurgico sterile, guanti sterili;
2.Preparazione del paziente:
Verifica della sedazione e curarizzazione del paziente;
Adeguamento della FiO2 al 100% previo controllo e impostazione del ventilatore automatico;
Eventuale tricotomia;
Detersione del cavo orale con soluzione di Iodiopovidone 2% e soluzione fisiologica in parti uguali;
Disinfezione della cute.
Posizionamento del paziente supino con il capo leggermente iperesteso mettendo sotto le spalle un rotolo del diametro di 10-15 cm;
Sospensione della dieta eventuale ed aspirazione del contenuto gastrico;
Posizionare placca elettrobisturi ben adesa alla cute e ben lontano dal campo operatorio(gamba);
Preparazione del campo sterile;
Preparazione del materiale (teli e garze sterili, disinfettante, set per tracheotomia chirurgica, set per tracheostomia percutanea, fili di sutura, ecc.).
Tecniche di tracheostomia
Chirurgica
— In anestesia generale;
— paziente in decubito supino con capo modicamente iperesteso e rialzo sopra le spalle;
— incisione orizzontale di 4-5 cm a livello dell’anello cricoideo se possibile in una piega del collo;
— scollamento del sottocute fino alla fascia;
— apertura della fascia sulla linea mediana fino sull’istmo della tiroide, sezione dell’istmo;
— accurata emostasi dei piani;
— incisione praticata a livello del II-III anello tracheale con forma di H o U rovesciata e/o asportazione di piccola aerea rotondeggiante di tessuto tracheale;
— posizionamento della cannula.
Tracheostomia translaringea secondo Fantoni
— In anestesia generale;
— paziente in decubito supino con capo modicamente iperesteso e rialzo sopra le spalle;
— sostituzione del tubo endotracheale con tracheoscopio rigido mediante laringoscopia diretta;
— introduzione ottica rigida;
— puntura cutanea sotto visione endoscopica diretta ed introduzione del filo guida, quindi suo avanzamento all’interno del tracheoscopio rigido fino al raggiungimento del connettore del tubo corrugato;
— rimozione dell’ago;
— sostituzione del tracheoscopio rigido con tubo endotracheale di piccolo diametro sino a 23-24 cm alle labbra;
— introduzione del mandrino guida sulla punta della cannula;
—accompagnamento della cannula nella sua introduzione all’interno del cavo orale con trazione costante fino all’emergenza alla cute della punta della cannula;
— incisione orizzontale della cute al punto di emergenza;
— taglio del filo e della cannula al livello indicato (foro prossimale al paziente);
— aspirazione delle secrezioni quando ancora la cannula è rivolta verso lo spazio glottico;
— estrazione-rotazione della cannula mediante apposito stiletto-otturatore bianco (la linea nera marker deve essere rivolta verso l’alto al termine della manovra di estrazione);
— verifica del corretto posizionamento endotracheale della cannula mediante
ottica rigida previa aspirazione. Rimozione del tubo endotracheale di piccolo diametro, cuffiare la cannula e connettere il ventilatore.

Tracheostomia percutanea secondo Griggs
— In anestesia generale;
— posizionamento del tubo endotracheale in modo che la punta si collochi tra le corde vocali;
— identificazione dei punti di repere classici (cartilagini tiroide e cricoide ed anelli tracheali);
— infiltrazione dal margine cricoideo fino al livello del terzo anello tracheale con una soluzione di bupivacaina 0,5% con adrenalina (1:200.000) a scopo antalgico e vasocostrittore;
— incisione orizzontale lunga meno di 1 cm, mantenendosi rigorosamente sulla linea mediana;
— eventuale dilatazione dei tessuti con pinza smussa;
— identificazione tramite palpazione della cartilagine cricoidea e dei primi anelli tracheali;
— inserimento fra il primo e il secondo anello di un agocannula 14G collegato ad una siringa contenente soluzione salina e verificare l’aspirazione di aria;
— inserimento di una guida metallica attraverso l’agocannula (rimosso dopo l’inserimento);
— sulla guida metallica avanzare fino al raggiungimento della trachea l’introduttore-dilatatore in dotazione,
— rimosso il dilatatore, introdurre sulla guida la apposita pinza Howard-Kelly
modificata fino al lume tracheale;
— apertura della pinza nel lume e uscita dallo stoma creato con pinza aperta;
— sulla guida metallica posizionamento della cannula tracheostomica montata su introduttore;
— connessione, previo gonfiaggio della cuffia della cannula, al ventilatore.

Tracheostomia percutanea secondo Ciaglia
Tracheostomia percutanea con modalità similari alla tecnica di Griggs, che prevede in luogo della pinza di Howard-Kelly modificata, una serie di dilatatori di calibro progressivamente più elevato, fino al posizionamento della cannula.
Fissaggio della cannula tracheostomica
Dopo l’esecuzione della tracheotomia una delle problematiche più importanti è la necessità del mantenimento in sede della cannula tracheostomica. L’immediata dislocazione comporta infatti, soprattutto nelle tecniche percutanee, la perdita del controllo delle vie aeree e una difficoltà elevata nel riposizionamento attraverso uno stoma che tende a richiudersi immediatamente.
È possibile ricorrere al posizionamento di punti chirurgici di fissazione della cannula, anche se sovente sono maltollerati dal paziente e sono fonte di possibili infezioni cutanee e di sanguinamento. In ogni caso i punti vengono solitamente rimossi in quarta giornata postoperatoria.
MEDICAZIONE
Dopo l’esecuzione della tracheostomia viene eseguita la medicazione della stomia con tecnica sterile.
I detergenti ed i disinfettanti usati a questo scopo sono solitamente:
Clorexidina alcoolica
Iodopovidone
REQUISITI FONDAMENTALI DEI DISINFETTANTI
Ampio spettro d’azione
Efficacia contro i microrganismi patogeni
Assenza di effetti dannosi per il materiale trattato e per il personale
Facilita’ di impiego
Basso costo
SOSTITUZIONE DELLA MEDICAZIONE
Se il paziente e’ in grado di collaborare, spiegare la procedura
Predisporre il materiale
Lavarsi le mani
Indossare i guanti ed evitare le contaminazioni
Rimuovere la medicazione sporca
Disinfettare intorno alla cannula con cura rimuovendo le secrezioni presenti
Applicare la nuova medicazione avendo cura di mantenerne la sterilita’
Sostituire la fettuccia di fissaggio della cannula
Riordinare, smaltire il materiale utilizzato e lavarsi le mani
Rinnovare la medicazione ogni qualvolta ce ne sia bisogno
CAMBIO CANNULA DI ROUTINE
Sostituzione della cannula
Si raccomanda di non sostituire la cannula prima di 4 giorni dal suo posizionamento.
In caso di necessità di sostituzione entro la prima settimana, è consigliato utilizzare un catetere da aspirazione di calibro adeguato rispetto alla cannula come guida per l’introduzione della nuova cannula per ridurre le percentuali di insuccesso alla reincannulazione legate al rimodellamento immediato dei tessuti.
Il cambio cannula in ORL, nel paziente sottoposto ad intervento di laringectomia totale viene fatto con cannule di metallo quotidianamente.
Si consideri che il paziente nel primo post operatorio viene trasferito presso il reparto di rianimazione con a dimora SNG e una cannula tipo TracheoSoft (per eventuale utilizzo di O2 terapia e/o ventilazione meccanica) e ritornerà in reparto solo il giorno successivo.
Il SNG verrà mantenuto per circa 10 gg fino alla completa cicatrizzazione della ferita in particolare dell’esofago cervicale.
Di norma il cambio cannula viene effettuato in ambulatorio.
Materiale occorrente:
· Telino non sterile per proteggere il paziente
· Copricamici per medico ed infermiere
· Fascetta o longhetta di garza
· Garza in rotolo 7 x 10
· Cerotto in seta o carta
· Bavaglino copri cannula
· Disinfettanti
· Garze bagnate per pulizia dello stoma
· Guanti in lattice o in vinile
· Carrello di medicazione in campo sterile contenente garze, batuffoli, set di ferri chirurgici
· Aspiratore rigido, di plastica o metallo
· Soluzione Fisiologica per lavaggio dell’aspiratore
· Cannula assemblata e pronta all’introduzione
· Lubrificante.
Nursing:
La medicazione ed il cambio cannula è giornaliero (salvo complicanze, vedi presenza di fistole esofago cutanee che necessitano di medicazioni più frequenti).
Il paziente viene smedicato e viene rimossa la cannula a dimora.
Il tracheostoma viene pulito con garze sterili imbevute di fisiologica. I punti di sutura invece vengono disinfettati con soluzioni a base di cloro o acqua ossigenata.
La ferita viene poi coperta e si esegue una fasciatura compressiva a livello del lembo cutaneo (eseguito per la laringectomia totale ed eventuali svuotamenti latero-cercicali associati) .
Ultimata la fascitura compressiva viene messa a dimora la nuova cannula sterile.
Ad ogni medicazione verrà sostituita la cannula tracheostomica che sarà del calibro 12 mm x 80/85/90 mm, a seconda delle caratteristiche del tracheostoma e della struttura del collo del paziente.
La lunghezza della cannula verrà alternata giorno per giorno per evitare possibili lesioni da decubito.
La fasciatura compressiva ha lo scopo di favorire l’accollamento dei tessuti ed evitare la formazione di fistole e verrà mantenuta per 10/12 giorni.
Vengono controllati i drenaggi in aspirazione che di solito si rimuoveranno in seconda – terza giornata..
Il drenaggio viene svuotato quotidianamente e la quantità di siero contenuta viene registrata nella cartella infermieristica del paziente.
Nelle prime giornate del post operatorio, il paziente avrà una abbondante secrezione bronchiale che potrà ostruire il lume della cannula.
In questo caso è necessario eseguire l’aspirazione al bisogno delle secrezioni ed eventualmente si potrà estrarre la controcannula che verrà pulita e rimessa in sito.
Se tutto procede senza complicanze verso il 10/12 giorno si procede alla rimozione del SNG previa prova dell’acqua per valutare l’eventuale presenza di fistole esofago-cutanee e controllare la normale funzione del riflesso di deglutizione.
Doppo 1-2 giorni inizierà una alimentazione graduale per os.
Pulizia del materiale e riordino
Mettere la cannula metallica in ammollo per circa 10 minuti con acqua calda e detergente disinfettante (a base di enzimi) o acqua ossigenata. Procedere poi alla pulizia con uno scovolino di nylon per il lume interno della cannula.
Lasciare asciugare ed infine porre negli appositi sacchetti per la sterilizzazione in autoclave.
Sorveglianza e procedure per le cure della stomia
Nella cura quotidiana della tracheostomia vanno considerati i seguenti fattori:
Posizione corretta della cannula con riferimento alla trazione esercitata dai raccordi del ventilatore ed alle manovre di mobilizzazione del paziente per evitare il dislocamento della stessa.
Una cannula tracheostomica di calibro adeguato deve essere immediatamente disponibile al letto del paziente.

Pervietà della cannula.
— Umidificazione:
i gas medicali vengono erogati direttamente in trachea, bypassando le vie aeree
superiori creando i presupposti per un rapido danneggiamento dell’equilibrio idrodinamico della mucosa tracheale. Il normale strato mucoso umido diventa secco e vischioso e provoca un aumento delle secrezioni e l’ostruzione delle vie aeree. La funzione ciliare viene rapidamente compromessa, inibendo il normale movimento in senso cefalico dello strato mucoso riducendo la depurazione batterica con comparsa di atelectasie e maggiore incidenza di fenomeni infettivi. Occorre quindi prestare massima attenzione a che siano messi in atto tutti quei presidi in grado di svolgere le funzioni normalmente deputate alla mucosa nasale (umidificatori e nebulizzatori).
La broncoaspirazione; solo in caso di necessità eseguita in assolutà sterilità con sondini di calibro adeguato (inferiore alla metà del diametro del tubo) e non oltrepassando la lunghezza della cannula.
Essendo una manovra irritativa e traumatica per
la mucosa la nostra esperienza e va pertanto eseguita solo in caso di necessità;
Integrità della cuffia.
— Una volta inserita la cannula è importante la monitorizzazione della pressione della cuffia. La sovrapressione favorisce la comparsa di sofferenza ischemica della mucosa tracheale con possibile necrosi. La pressione capillare dei vasi della mucosa tracheale è compresa normalmente tra i 20-25 mmHg: scopo della
sorveglianza infermieristica è il mantenimento di pressioni di gonfiaggio della cuffia inferiori ai 20 cmH2O.
Le problematiche legate a sottopressioni della cuffia sono più facilmente valutabili in quanto vanno a ridurre la tenuta della via aerea definitiva. È possibile valutare queste problematiche in maniera immediata tramite l’ascolto di rumori respiratori caratteristici.
Tecnicamente un ausilio fondamentale è determinato dalla considerazione delle
discrepanze tra i volumi inspiratori ed espiratori registrati al ventilatore.
Infiammazione del tracheostoma.
— La valutazione della stomia, effettuata con scadenza giornaliera permette di valutare la situazione locale dello stoma con la possibilità di prevenire, tramite una disinfezione ed una detersione adeguate, le complicanze infettive. La presenza di un cercine infiammatorio o con connotazioni purulente rappresenta
indicazione all’esecuzione di tampone cutaneo, correlata a tamponi colturali
delle vie aeree superiori. La presenza di segni di infezione sistemica (leucocitosi, febbre, interessamento organico, ecc.) dovrebbe portare al completamento delle indagini con esami colturali delle vie aeree inferiori (BAL)
Complicazioni nella tracheotomia
Stenosi tracheale: tessuto cicatriziale a lato della cannula tracheostomica, spesso causata da un’eccesivo gonfiaggio della cuffia.
Fistola transesofageatracheale: una connessione anormale tra la trachea e l’esofago .
Granuloma (molto comune): una crescita del tessuto infiammatorio, che è causata dall’irritazione della mucosa dalla presenza estranea della cannula
Infezioni
Tracheiti
Sanguinamento
— La valutazione immediata nel perioperatorio e la valutazione quotidiana devono mirare alla precoce identificazione di eventuali sanguinamenti dello stoma al fine di poter eseguire medicazione compressiva considerando l’eventualità di una revisione chirurgica dello stoma.
— Ammontare di tanti piccoli sanguinamenti (mucosa rosa o rossa) spesso come risultato di broncoasprazioni di routine. Questo sanguinamento puo’ essere gestito con l’osservazione attenta e continua .
Irritazione del tessuto delicato intorno allo stoma
Insufficiente umidificazione dell’aria
Molto frequentemente, profonda o eccessiva broncoaspirazione
Pressione eccessiva del broncoaspiratore (Pressione dell’aspiratore deve essere di 100-120mm Hg)
Infezioni
Trauma della trachea
Tosse eccessiva
Osservazione del paziente tracheostomizzato
Rilevazione della frequenza respiratoria
Monitoraggio della frequenza cardiaca e della pressione arteriosa.
Rilevazione della saturazione arteriosa dell’ossigeno
Emogasanalisi
Broncospasmo,stridore della cannula
Cianosi o marezzatura cutanea.
Ipossiemia, aritmie
Agitazione,ansia,confusione mentale
Utilizzo della muscolatura accessoria durante la respirazione
Vasocostrizione periferica
Astenia, apatia,sopore.
Eventuale ostruzione per secrezioni,cannula inappropriata o dislocazione della stessa.
Enfisema sottocutaneo e mediastinico pneumotorace.
— Nell’ambito della valutazione infermieristica la presenza di enfisema sottocutaneo al collo o di crepitii sottocutanei peristoma sono indicazioniper una immediata valutazione radiografica di eventuale pneumotorace o pneumomediastino.
Devono essere tenute in considerazioni eventuali contaminazioni batteriche
da parte di una flora anaerobia con produzione di gas nelle zone sottocutanee legate normalmente a cellulite batterica.
Emorragia (sanguinamento)
Atelettasia polmonare
Infezioni tracheo bronchiali
Aspirazione di secrezioni o contenuto gastrico
Le raccomandazioni del “The Joanna Briggs Institute
Raccomandazioni
1. L’aspirazione deve essere fatta solo quando è stata compiuta una valutazione completa del paziente ed è stata stabilita la
necessità per tale procedura. Si raccomanda una valutazione individuale preliminare, ed una accurata osservazione
durante e dopo la procedura. Il paziente deve essere incoraggiato a tossire e ad espettorare autonomamente se è in grado.
(Livello IV)
2. A causa dei potenziali rischi associati, gli infermieri devono possedere abilità procedurali e delicatezza per eseguire la
manovra di l’aspirazione. (Livello IV)
3. Gli infermieri non devono instillare la soluzione fisiologica allo 0.9% prima di aspirare gli adulti con tracheostomia o
intubati. Accertando che i pazienti siano adeguatamente idratati è un modo con il quale gli infermieri possono facilitare la
rimozione delle secrezioni respiratorie. (Livello III.1)
4. Devono essere utilizzate tecniche asettiche durante l’aspirazione dei pazienti adulti ospedalizzati con tracheostomia.
(livello IV)
5. La misura del sondino di aspirazione non deve occupare più di metà del diametro interno della via respiratoria artificiale
per evitare pressioni negative maggiori nelle vie respiratorie e per minimizzare la caduta della PaO2. (livello IV)
6. L’opinione degli esperti suggerisce che la durata dell’aspirazione deve essere inferiore ai 10 -15 secondi. (livello IV)
7. Alcune forme di iperossigenazione prima di compiere l’aspirazione possono ridurre la potenziale ipossiemia postaspirazione
nei pazienti adulti ospedalizzati. (livello III.1)
Combinando l’iperossigenazione e l’iperinsuflazione si può potenzialmente minimizzare l’ipossiemia indotta
dall’aspirazione. (livello III.1)
8. Utilizzando volumi correnti proporzionali alle dimensioni del paziente si può contribuire ad una riduzione delle difficoltà
potenziali. (livello III.1)
9. Quando si iperossigena, lasciare il tempo perché l’aumentata percentuale di ossigeno passi attraverso i tubi del ventilatore
e raggiunga il paziente. (livello IV)
10. Deve essere utilizzato un ventilatore, piuttosto che un dispositivo di rianimazione manuale, per fornire
l’iperventilazione/iperossigenazione prima di aspirare al fine di ridurre le alterazioni emodinamiche. (livello III.2)
11. Utilizzare al massimo due passaggi di aspirazione. (livello III.1)
12. È necessaria una completa valutazione del paziente per pianificare gli interventi di aspirazione. L’iperinsuflazione può avere
implicazioni cliniche per pazienti che hanno un aumento della PIC o che hanno di recente subito un intervento vascolare o
cardiochirurgico o che sono emodinamicamente instabili. (livello II)
13. Modificare le attività e distanziare gli interventi che sono riconosciuti responsabili nel determinare un aumento della MICP
o MAP con intervalli di almeno 10 minuti. Le azioni devono essere pianificate su una completa valutazione dei bisogni del
paziente; quando possibile occorre considerare le attività di assistenza passo per passo piuttosto che farle come attività consolidate
Riassunto delle evidenze
1. I traumi tracheali, l’ipossiemia indotta dalla aspirazione, l’ipertensione, le aritmie cardiache e l’aumento della pressione intracranica
sono state associate alle procedure di aspirazione. (livello III.3)
2. I pazienti hanno riferito che l’aspirazione può essere una procedura dolorosa e ansiogena. (livello IV)
3. Somministrare un bolo di soluzione fisiologica allo 0.9%, per rendere più liquide le secrezioni, non è convalidato in letteratura. (livello
III.1)
4. C’è un rischio potenziale che più batteri entrino nelle basse vie aeree durante ripetute operazioni di aspirazione, in particolare se è
utilizzata in modo routinario l’instillazione di soluzione fisiologica come parte della procedura. (livello IV)
5. Il rapporto del diametro del sondino di aspirazione rispetto al diametro del tubo endotracheale può essere direttamente correlato alla
pressione negativa all’interno del polmoni. (livello IV) La caduta dei livelli di PO2 è stata riferita essere maggiore quando sono
utilizzati sondini per aspirazione più grossi. (livello III.2)
6. Se si raddoppia la durata del periodo di aspirazione si possono dimezzare i livelli di PO2. (livello III.1)
7. L’iperossigenazione prima dell’aspirazione può potenzialmente ridurre l’ipossiemia indotta dalla manovra. Associando
l’iperossigenazione con l’iperventilazione si può minimizzare l’ipossiemia indotta dall’aspirazione. (livello III.1)
8. I pazienti hanno riferito sensazioni di dispnea durante l’iperventilazione condotta con volumi maggiori del volume corrente (900 cc).
(livello III.1)
9. Un periodo di pausa fino a 2 minuti può essere necessario quando l’iperossigenazione è realizzata attraverso dei vecchi respiratori,
al fine di dare tempo perché l’aumentata percentuale di ossigeno attraversi i tubi del ventilatore e raggiunga il paziente. (livello IV)
10. L’uso del ventilatore per fornire l’iperossigenazione e l’iperventilazione può determinare meno alterazioni emodinamiche rispetto
l’uso di dispositivi manuali per la ventilazione (MRB). (livello III.2)
11. Aumenti nella MICP, MAP e nei livelli di CPP nei pazienti con traumi cerebrali acuti possono essere associati all’aspirazione e questi
cambiamenti si possono sommare ad ogni sequenza di aspirazione successiva. (livello III.1)
12. Ripetute sequenze di iperventilazione-aspirazione possono portare a modifiche emodinamiche significative nella MAP, nella attività
cardiaca e nel ritmo cardiaco. (livello II)
13. I pazienti con severi traumi chiusi del capo, in particolare coloro che rispondono con un innalzamento della PIC, sono a rischio di ipertensione intracranica durante l’aspirazione
Facilitare la fonazione nel paziente tracheostomizzato.
Inviato da S.R. – Ultimo aggiornamento (Thursday 02 March 2006)
Hess DR, Department of Respiratory Care, MassachussetsGeneralHospital, Boston
Respiratory Care, April 2005, Vol 50 No 4
Traduzione italiana
La cannula tracheostomica riduce l’abilità del paziente di comunicare con efficacia.
La possibilità di parlare rappresenta un elemento fondamentale per la qualità della vita del paziente tracheostomizzato.
Nel paziente ventilato è possibile la fonazione utilizzando
– una cannula fenestrata
– una cannula scuffiata con valvola fonatoria
– una cannula scuffiata senza valvola fonatoria.
La fonazione può essere facilitata nel paziente con una cannula tracheale e in respiro spontaneo con:
– una cannula fenestrata
– l’occlusione con il dito in presenza della cannula scuffiata
– l’uso della valvola fonatoria con cannula scuffiata
Il lavoro integrato tra paziente ed equipe (fisioterapista respiratorio, logopedista, infermiere) può portare a un’ efficace promozione della fonazione in molti pazienti che necessitano della tracheostomia per un lungo periodo.
Traduzione di alcuni estratti dall’articolo.
Nel paziente in respiro spontaneo la fonazione è possibile, in particolare, tramite:
1. Occlusione della cannula tracheale scuffiata con un dito: il paziente (o il care giver) può posizionare il dito sulla cannula per permettere all’aria di raggiungere le alte vie aeree. Per molti pazienti questa tecnica è di facile esecuzione,
ma altri non hanno la coordinazione necessaria per utilizzare questo metodo.
2. Occlusione della cannula tracheale scuffiata con valvola fonatoria: nel paziente in respiro spontaneo la valvola fonatoria permette all’aria espiratoria di raggiungere le vie aeree superiori e di permettere al paziente la fonazione. Questa metodica è probabilmente la più comune per facilitare la fonazione in questi pazienti. Nonostante però in molti casi venga usata con efficacia, esistono anche alcune controindicazioni.
La valvola fonatoria può essere usata nel paziente vigile, responsivo, che accenna tentativi di comunicazione.
Le condizioni cliniche devono essere stabilizzate e deve essere mantenuta la cannula scuffiata.
Nonostante la valvola fonatoria faciliti l’espettorazione orale delle secrezioni è necessaria, prima del posizionamento, la broncoaspirazione se il paziente presenta abbondanti secrezioni.
Prima del posizionamento, inoltre, è necessario valutare il rischio di inalazione (attenzione alle inalazioni silenti) in quanto la valvola è controindicata in pazienti con un rischio elevato.
Non devono essere presenti ostruzioni a livello delle vie aeree superiori (esempio tumori, stenosi, tessuti di granulazione, secrezioni).
È necessario inoltre valutare il diametro della cannula e prenderne in considerazione l’eventuale riduzione.
Anche la cuffia può creare un’ostruzione, nonostante sia sgonfia. In tal caso valutare la sostituzione di una cannula con una non cuffiata o eventualmente con una fenestrata.
Prima di posizionare la valvola controllare che la cannula sia completamente scuffiata e che le secrezioni siano state rimosse.
Testare la tollerabilità dell’occlusione del tracheostoma con un dito e dopo il posizionamento della valvola: osservare la funzionalità respiratoria del paziente (alcuni pazienti necessitano di un training di adattamento) monitorando
la funzione respiratoria (fondamentale la saturazione) e cardiaca.
Se il paziente mostra difficoltà respiratorie è necessario rimuovere la valvola.
Oltre a promuovere la fonazione, la valvola fonatoria può avere altri benefici. Alcuni studi evidenziano che può promuovere la deglutizione e ridurre il rischio di inalazione. Sono riportati inoltre studi che evidenziano la promozione dell’olfatto.
Informazione all’utente
Cos’è la Tracheostomia?
La tracheostomia è un tubicino ricurvo creato per essere inserito direttamente nelle vie respiratorie (superiori) del paziente, all’altezza del collo. L’intervento chirurgico necessario all’inserimento della trachoeostomia viene chiamato Tracheotomia. L’inserimento può venire praticato dal chirurgo in sala operatoria oppure al Reparto di Cura Intensiva, dal medico addetto al Reparto
Come Funziona?
Quando il polmone artificiale viene usato per più di 5 –10 giorni, o in casi di perdita di conoscenza, per aiutare il paziente ad una respirazione più soddisfacente viene praticata la tracheostomia. Nella maggior parte dei casi, quando il paziente comincia a migliorare, il tubo della tracheostomia potrà essere rimosso. Il foro che è stato praticato si richiude e la respirazione riprenderà in modo naturale. Per alcuni pazienti sarà necessario tenerla per periodi più lunghi. Quando ciò occorre, vi è una equipe di medici, infermieri, fisioterapisti e locoterapisti che saranno d’aiuto al paziente per la rimozione del tubo. Ció potrà richiedere giorni o mesi.
I tubi della trachestomia causano spesso al paziente l’impossibilità di poter parlare, specialmente quando corrono il rischio di ingoiare cibi solidi o liquidi verso la trachea e quindi verso i polmoni. Man mano che il paziente va migliorando, verranno usati tubi diversi che permetteranno al paziente di poter parlare. Alcuni pazienti saranno costratti all’uso permanente della tracheostomia.
Vi sono delle Complicazioni?
Tutti gli interventi e procedure a carattere di Cura Intensiva hanno dei rischi potenziali anche quando portati a termine da personale esperto.
Qualche Domanda?
Logicamente se avete delle domande o siete preocupati di qualcosa, discutetene con il Personale addetto al Reparto di Cura Intensiva (CCU)
Per la gestione della tracheostomia a domicilio, vi rimandiamo all’opuscolo informativo a cura del personale del Reparto di Otorinolaringoiatria dell’Ausl della Val d’Aosta, che potrete trovare all’indirizzo http://www.ausl.vda.it
Bibliografia
ASSISTENZA INFERMIERISTICA PER L’ESECUZIONE DELLA TRACHEOSTOMIA Andrea Murachelli I.P. Terapia Intensiva Post Operatoria – Policlinico Multimedica (Milano-Sesto san Giovanni)
GESTIONE DELLA CANNULA TRACHEOSTOMICA
Protocollo di: Lucia Zanovello, Cristina Ruffo, Paola Frattini, Gloria Lonardi
In collaborazione con il Dott Leopoldo Vaona
Unità Operativa di O.R.L. – ASL 21 Ospedale Mater Salutis, Legnago (VR)
http://scientifico.pneumonet.it
http://intensivecare.hsnet.nsw.gov.
Nursing della tracheotomia N. NAVA, M. BAIOCCHI, A. LUCCHINI*
Servizio di Anestesia e Rianimazione Azienda Ospedaliera L. Sacco – Milano
Servizio di Anestesia e Rianimazione Azienda Ospedaliera San Gerardo – Monza
Facilitare la fonazione nel paziente tracheostomizzato. Inviato da S.R. – Ultimo aggiornamento (Thursday 02 March 2006) Hess DR, Department of Respiratory Care, Massachussets General Hospital, Boston Respiratory Care, April 2005, Vol 50 No 4 – Traduzione italiana dell’abstract
http://www.fli.it – Federazione Logopedisti Italiani
http://www.evidencebasednursing.it

Cancro laringeo, nuovo intervento Operazione meno invasiva per l’asportazione del carcinoma alla laringe
Il carcinoma alla laringe ogni anno in Italia colpisce circa 7000 persone ed è causa di morte per 1500 malati. Sembra prediligere il sesso maschile (rapporto di 9 a 1), con una frequenza crescente dopo i 50 anni.
Le cause più frequenti sono rappresentate dall’uso del fumo di tabacco e l’assunzione di notevoli quantità di alcool. Altre cause sembrano essere la prolungata esposizione alle fibre di asbesto (meglio noto come amianto), agli anticrittogamici e ai pesticidi. Un ruolo importante sembra avere, inoltre, il contagio con il Papilloma Virus. Ma le cause più frequenti sono di natura genetica, e sarà dalla farmaco genetica e dalla genetica nutrizionale che in futuro arriveranno le nuove terapie farmacologiche. Questo il tema principale del Congresso nazionale della Società italiana di otorinolaringologia e chirurgia cervico-facciale (SIOeChCF), che si terrà a Riccione dal 19 al 22 maggio, durante il quale si svilupperà proprio il tema delle attualità in oncologia laringea. Tra gli aggiornamenti più importanti sicuramente quello che affronterà il problema, forse ancor oggi più grave e non del tutto risolto, rappresentato dalle gravi mutilazioni che sono la conseguenza della laringectomia totale, intervento altamente mutilante e spesso causa di isolamento e di emarginazione sociale.
A tal riguardo è stato ideato un intervento che, pur asportando gran parte della laringe, permette la conservazione della voce e l’eliminazione del tracheostoma. Riportato sulla rivista scientifica Laryngoscope, è frutto dello studio di Giuseppe Rizzotto e Giovanni Succo, e in via di introduzione in tutti i più importanti centri oncologici europei. I risultati della ricerca saranno presentati durante il congresso. Ma non solo. “Come è tradizione – spiega Alberto Rinaldi Ceroni, presidente del congresso e presidente Sio – anche quest’anno ospiteremo una faculty italiana ed estera, quest’ultima numerosa e variegata per paesi di origine, entrambe di eccellenza professionale.
Saranno presenti i più autorevoli esponenti in ambito otochirurgico, roncochirurgico – uno per tutti Tucker Woodson, presidente della Società mondiale di chirurgia delle apnee ostruttive nel sonno- della chirurgia endoscopica del naso e dei seni paranasali e della chirurgia pediatrica”.
Saranno poi trattate le più recenti innovazioni nell’ambito dei vari campi che costituiscono la specialità. “In particolare – prosegue Ceroni – David Terris, docente alla Georgia’s Health Sciences University, terrà una lezione magistrale sull’utilizzo e i vantaggi delle nuove tecnologie applicate alla chirurgia della tiroide”.